Образование мочевины. Обезвреживание аммиака. синтез мочевины
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса .
Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса - цикла трикарбоновых кислот. Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат - метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота .
Орнитиновый цикл в печени выполняет две функции:
Превращение аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
Синтез аргинина и пополнение его фонда в организме.
Рассмотрим цикл мочевины:
![]()
Рисунок 34 - Орнитиновый цикл синтеза мочевины в печени
Начинается он с образования карбамоилфосфата в митохондриях, где много АТФ.
1 Образование карбамоилфосфата . Ионы аммония, возникшие в результате окислительного дезаминирования глутаминовой кислоты, взаимодействуют с гидрокарбонат - анионом и АТФ при участии карбамоилфосфатсинтетазы, образуя карбамоилфосфат, содержащий макроэргическую связь:
NН 4 + + НСО 3 - + 2АТФ → Н 2 N - С + 2АДФ + Н 2 РО 4 - + Н +
Карбамоилфосфат
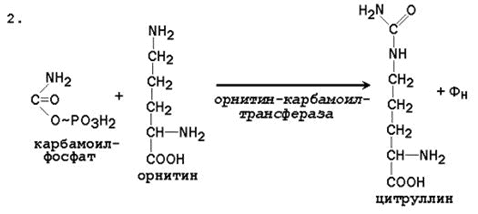
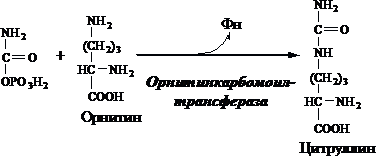
2. Получение цитруллина . В матриксе митохондрий карбамоилфосфат конденсируется с аминокислотой орнитином, которая, являясь гомологом лизина, не входит в состав белков.
Реакция катализируется орнитинкарбамоилтрансферазой :
Н СОО - О Н СОО -
С + Н 2 N - С → СО + Н 2 РО 4 -
+ / \ + \ + / \ ||
Н 3 N (СН 2) 3 NН 3 О ~ Ф Н 3 N (СН 2) 3 NН - С - NН 2
Орнитин Карбамоилфосфат цитруллин
Образующийся цитруллин переходит в цитозоль клеток печени, где и происходят остальные реакции цикла мочевины.
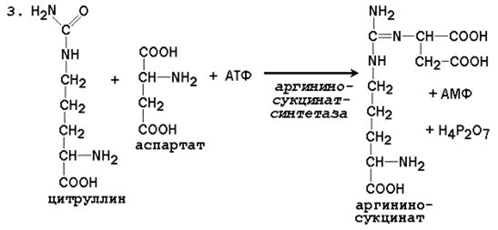
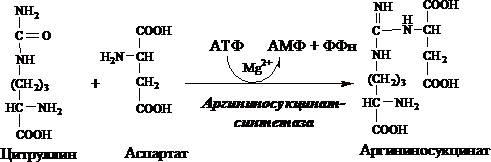
3. Получение аргининосукцината . Замещение карбонильной группы цитруллина на аминогруппу аспартата с образованием гуанидиновой группировки аргининосукцината происходит при участии АТФ и катализируется аргининосукцинатсинтетазой:
Н СОО - Н СОО -
С О + С + АТФ →
Н 3 N (СН 2) 3 NН - С - NН 2 Н 3 N СН 2 СОО -
Цитруллин аспартат
С Н 2 N СН 2 СОО - + Н 2 Р 2 О 7 2- + АМФ
Н 3 N (СН 2) 3 NН - С - NН - СНСОО -
Аргининосукцинат
Реакция эндэргоническая, на протекание первой и третьей реакций цикла расходуется 4 молекулы АТФ.
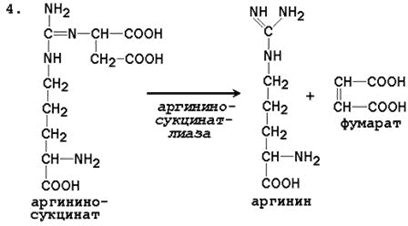
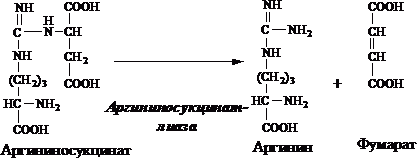
4. Распад аргининосукцината . Под действием аргининосукцинатлиазы аргининосукцинат экзэргонически расщепляется с образованием аргинина и фумарата:
Н СОО - Н СОО - СОО - Н
С Н 2 N СН 2 СОО - → С Н 2 N + С = С
+ / \ || | + / \ || / \
Н 3 N (СН 2) 3 NН - С - NН - СНСОО - Н 3 N (СН 2) 3 NН - С - NН 2 Н СОО -
Аргининосукцинат Аргинин Фумарат
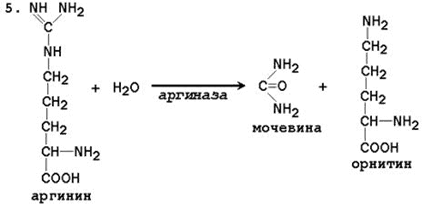
5. Образование мочевины и регенерация орнитина. Гидролиз аргинина, катализируемый аргиназой, приводит к образованию мочевины и регенерации орнитина. Реакция экзэргонична.
Н СОО - Н СОО - NН 2
С Н 2 N → С + О = С
+ / \ || + / \ + \
Н 3 N (СН 2) 3 NН - С - NН 2 Н 3 N (СН 2) 3 NН 3 NН 2
Аргинин Орнитин Мочевина
Регенерированный орнитин может снова поступать в митохондрии и участвовать в новом обороте цикла мочевины. Образующуюся мочевину кровь переносит из печени в почки, где извлекается из крови и удаляется из организма с мочой.
В орнитиновом цикле расходуется 4 макроэргические связи трех молекул АТФ на каждый оборот цикла.
Однако процесс образования мочевины обеспечивает сам себя энергией:
При регенерации аспартата из фумарата на стадии дегидрирования малата образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
При окислительном дезаминировании глутамата в разных органах тоже образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
Из приведенных реакций видно, что токсичный аммиак превращается в безвредную мочевину. При этом один из атомов азота мочевины образуется из аммиака, другой - из аспартата.
24.4.1. Биосинтез мочевины - основной путь обезвреживания аммиака. Мочевина синтезируется в орнитиновом цикле, протекающем в клетках печени. Эту последовательность реакций открыли Х.Кребс и К.Хензелейт в 1932 г. Согласно современным представлениям, цикл мочевины включает последовательность пяти реакций.
Две начальные реакции биосинтеза мочевины происходят в митохондриях клеток печени.
Последующие реакции протекают в цитоплазме клеток печени.
Общая схема орнитинового цикла представлена на рисунке 24.2:
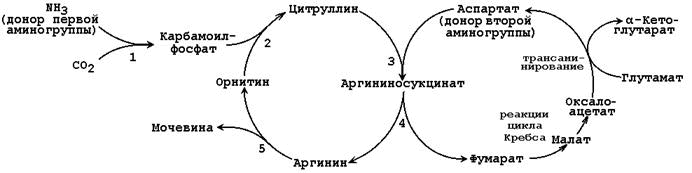
Рисунок 24.2.
Схема орнитинового цикла и его связь с превращениями фумаровой и аспарагиновой кислот.
Цифрами обозначены ферменты, катализирующие реакции орнитинового цикла: 1 - карбамоилфосфатсинтетаза; 2 - орнитин-карбамоилтрансфераза; 3 - аргининосукцинатсинтетаза; 4 - аргининосукцинатлиаза; 5 - аргиназа.
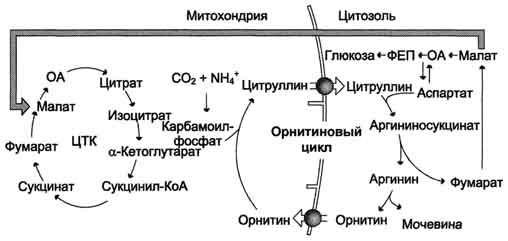
24.4.2. Орнитиновый цикл находится в тесной взаимосвязи с циклом трикарбоновых кислот :
- пусковые реакции цикла мочевины, как и реакции ЦТК, протекают в митохондриальном матриксе;
- поступление СО2 и АТФ, необходимых для образования мочевины, обеспечивается работой ЦТК;
- в цикле мочевины образуется фумарат, который является одним из субстратов ЦТК. Фумарат гидратируется в малат, который в свою очередь окисляется в оксалоацетат. Оксалоацетат может подвергаться трансаминированию в аспартат; эта аминокислота участвует в образовании аргининосукцината.
24.4.3. Регуляция активности ферментов цикла осуществляется главным образом на уровне карбамоилфосфатсинтетазы, которая малоактивна в отсутствие своего аллостерического активатора - N-ацетил-глутамата. Концентрация последнего зависит от концентрации его предшественников (ацетил-КоА и глутамата), а также аргинина, который является аллостерическим активатором N-ацетилглутаматсинтазы:
Ацетил-КоА + Глутамат N-ацетилглутамат + КоА-SH
Концентрация ферментов орнитинового цикла зависит от содержания белка в пищевом рационе. При переходе на диету, богатую белком, в печени повышается синтез ферментов орнитинового цикла. При возвращении к сбалансированному рациону концентрация ферментов снижается. В условиях голодания, когда усиливается распад тканевых белков и использование аминокислот как энергетических субстратов, возрастает продукция аммиака, концентрация ферментов орнитинового цикла увеличивается.
24.4.4. Нарушения орнитинового цикла . Известны метаболические нарушения, обусловленные частичным блокированием каждого из 5 ферментов, катализирующих в печени реакции синтеза мочевины, а также N-ацетилглутаматсинтазы. Эти генетические дефекты, очевидно, являются частичными. Полное блокирование какой-либо из стадий цикла мочевины в печени, по-видимому, несовместимо с жизнью, потому что другого эффективного пути удаления аммиака не существует.
Общим признаком всех нарушений синтеза мочевины является повышенное содержание NH4 + в крови (гипераммониемия ). Наиболее тяжёлые клинические проявления наблюдаются при дефекте фермента карбамоилфосфатсинтетазы. Клиническими симптомами, общими для всех нарушений цикла мочевины, являются рвота, нарушение координации движений, раздражительность, сонливость и умственная отсталость. Если заболевание не диагностируется, то быстро наступает гибель. У детей старшего возраста проявлениями заболевания служат повышенная возбудимость, увеличение размеров печени и отвращение к пище с высоким содержанием белка.
Лабораторная диагностика заболеваний включает определение содержания аммиака и метаболитов орнитинового цикла в крови, моче и спинномозговой жидкости; в сложных случаях прибегают к биопсии печени.
Значительное улучшение наблюдается при ограничении белка в диете, при этом могут быть предотвращены многие нарушения мозговой деятельности. Малобелковая диета приводит к снижению содержания аммиака в крови и к улучшению клинической картины при мягких формах этих наследственных нарушений. Пищу следует принимать часто, небольшими порциями, для того чтобы избежать резкого повышения уровня аммиака в крови.
24.4.5. Клинико-диагностическое значение определения мочевины в крови и моче. В крови здорового человека содержание мочевины составляет 3,33 - 8,32 ммоль/л. За сутки с мочой выводится 20 - 35 г мочевины.
Изменения содержания мочевины в крови при заболеваниях зависят от соотношения процессов её образования в печени и выведения почками. Повышение содержания мочевины в крови (гиперазотемия) отмечается при почечной недостаточности, снижение - при недостаточности печени, при диете с низким содержанием белков.
Повышение экскреции мочевины с мочой наблюдается при употреблении пищи с высоким содержанием белков, при заболеваниях, сопровождающихся усилением катаболизма белков в тканях, при приёме некоторых лекарств (например, салицилатов). Снижение экскреции мочевины с мочой характерно для заболеваний и токсических поражений печени, заболеваний почек, сопровождающихся нарушением их фильтрационной способности.
Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии
Биология и генетика
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. Экскреция мочевины в норме составляет 25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается.
Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии.
Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина).
Мочевина (карбамид) - полный амид угольной кислоты - содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы I.
![]()
Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота цитруллин. Следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Этот фермент нуждается в ионах Mg2+. В реакции затрачивается 1 моль АТФ, но используется энергия двух макроэргических связей. Аспартат - источник второго атома азота мочевины Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Кофакторами аргиназы являются ионы Са2+ или Мn2+. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7.
Взаимосвязь орнитинового цикла и общего пути катаболизма. Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
Гипераммониемия Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла:
Наследственные нарушения орнитинового цикла и основные их проявления
|
Заболевание |
Дефект фермента |
Тип наследования |
Клинические проявления |
Метаболиты |
|
|
кровь |
моча |
||||
|
Гиперам- мониемия, тип I |
Карбамоил- фосфат- синтетаза I |
Аутосомно- рецессивный |
В течение 24-48 ч после рождения кома, смерть |
Глн Ала NH3 |
Оротат |
|
Гиперам- мониемия, тип II |
Орнитин- карбамоил- трансфераза |
Сцепленный с Х-хромосомой |
Гипотония, снижение толерантности к белкам |
Глн Ала NH3 |
Оротат |
|
Цитрул- линемия |
Аргинино- сукцинат- синтетаза |
Аутосомно- рецессивный |
Гипераммониемия тяжёлая у новорождённых. У взрослых - после белковой нагрузки |
Цитруллин NH3 |
Цитруллин |
|
Аргинино- сукцина- турия |
Аргинино- сукцинат- лиаза |
Аутосомно-рецессивный |
Гипераммонимия, атаксия, судороги, выпадение волос |
Аргини- носукцинат NH3 |
Аргини- носукци- нат, Глн, Ала, Лиз |
|
Гиперар- гининемия |
Аргиназа |
Аутосомно-рецессивный |
Гипераргининемия |
Apr NH3 |
Apr Лиз Орнитин |
Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Так, при дефекте аргининосук-цинатсинтетазы повышается содержание цитруллина (цитруллинемия); при дефекте аргиназы - концентрация аргинина, аргининосукцината, цитруллина и т.д. При гипераммониемиях I и II типа вследствие дефекта орнитинкарбамоилтрансферазы происходит накопление карбамоилфосфата в митохондриях и выход его в цитозоль. Это вызывает увеличение скорости синтеза пиримидиновых нуклеотидов (вследствие активации карбамоилфосфатсинтетазы II), что приводит к накоплению оротата, уридина и урацила и выведению их с мочой. Содержание всех метаболитов повышается, и состояние больных ухудшается при увеличении количества белков в пище. Тяжесть течения заболевания зависит также от степени снижения активности ферментов. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина.
Гипераммониемия сопровождается появлением следующих симптомов:
- тошнота, повторяющаяся рвота;
- головокружение, судороги;
- потеря сознания, отёк мозга (в тяжёлых случаях);
- отставание умственного развития (при хронической врождённой форме
- Все симптомы гипераммониемии - проявление действия аммиака на ЦНС (см. выше подраздел IV, Б).
Для диагностики различных типов гипераммониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, акгивности фермента в биоптатах печени. Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л). Однако в большинстве хронических случаев уровень аммиака может повышаться только после белковой нагрузки или в течение острых осложнённых заболеваний.
А также другие работы, которые могут Вас заинтересовать |
|||
| 28799. | Какими характерными чертами отмечено социально-культурное развитие восточно-славянских племен в 6-9вв | 19.3 KB | |
| Предки славян принадлежали к древнему индоевропейскому единству. Одним из них и стали славяне. Позднее в славянском массиве возникают западные венеды и восточные анты ветви. | |||
| 28800. | Как происходило образование Древнерусского государства? Какие точки зрения по этому вопросу вам известны | 21.64 KB | |
| Образование государства у восточных славян длительный процесс растянутый во времени благодаря чему сохранились пережитки племенной демократии. ОБРАЗОВАНИЕ ДРЕВНЕРУССКОГО ГОСУДАРСТВА 1. К политическим факторам образования государства у восточных славян следует отнести усложнение внутриплеменных отношений и межплеменные столкновения которые ускоряли становление княжеской власти повышали роль князей и дружины как обороняющих племя от внешних врагов так и выступающих в качестве арбитра при различного рода спорах. | |||
| 28801. | Государство Киевская Русь и его цивилизационные особенности (социально-политический строй, экономика, законодательство, культура) | 16.04 KB | |
| на Руси распространялись славянские азбуки кириллица и глаголица созданные Кириллом и Мефодием. На Руси широкое распространение получила грамотность также ставшая результатом принятия христианства и появления литературы на славянском языке. Было принято христианство означавшее включение Руси в христианский мир. Для Киевской Руси характерно было слабое юридическое развитие недостаточность развития государственных начал отсутствие единства приведшее к последующему распаду. | |||
| 28802. | Почему Русь приняла христианство? Какое значение имело принятие христианства для развития страны | 13.83 KB | |
| Культурные связи с более развитыми странами и прежде всего с Византией содействовали принятию христианства. Принятие христианства имело колоссальное политическое и культурное значение в русской истории: 1. Влияние христианства на развитие культуры проявилось в распространении на Русь славянской письменности развитии иконописи. | |||
| 28803. | Каковы причины политической раздробленности на Руси? Дайте характеристику русских княжеств и земель в условиях децентрализации Киевской Руси | 15.29 KB | |
| Причины: борьба за власть рост городов набеги кочевников Киев теряет свое значение 1ВладимироСуздальскаяЮрий Долгоруковвласть принадлежала князю 2Галецко Волынская князь Даниил Романович власть принадлежала боярем князю 3Новгород власть вече народное собрание Последствие раздробленности: новые торговли развитие новых город развитие культур ослабление междоусобных войск и дробление княжеств ослабление центральной власти. | |||
| 28804. | Русь и Золотая Орда. Какие оценки монгольского фактора в истории России существуют в исторической литературе | 15.88 KB | |
| Карамзина состояли в следующем: согласие с татарами позволившее провести 40 мирных лет; большая заслуга перед своей малой Родиной Московским княжеством: обогатил усилил расширил; ЛН Гумилев считал что монголотатарского ига на Руси не было Нашествия Батыя были лишь военным рейдом и последующие события не имеют к нему непосредственного отношения Он утверждал что Великое княжество Владимирское в лице Александра Невского добилось выгодного союза с Золотой Ордой В 1237 г. Батый вторгся в земли Руси. ×Ярлык на княжение зависимые... | |||
| 28805. | Каковы причины возвышения Москвы? Какие еще альтернативы объединения Руси вы могли бы назвать | 14.07 KB | |
| свержение монголотатарского ига Иван III происшедшее мирным путем после отказа платить дань Орде и последующего стояния на Угре русского и татарского войск друг против друга когда хан так и не решился вступить в битву. первый свод законов нового объединенного Русского государства Судебник Ивана III. завершение процесса объединения при сыне Ивана III Василии III. | |||
| 28806. | Образование централизованного Московского государства в 15-16вв. Чем данный процесс в России отличается от западноевропейского | 13.91 KB | |
| Особенностями политической системы Московского царства были: а внутренней: 1 авторитарный характер государственной власти 2 превращения Руси с XV в и единственное в мире независимое православное государство; 3 закрепление политической и культурной изоляции и отставания от Европы; б внешней: 1 огромная территория государства 2 превращение Руси в многонациональное государство Завершающий этап централизации Русского государства связан с именем и царствованием внука Ивана III Ивана Грозного впервые принявшего в 1547 г. Тем самым... | |||
| 28807. | Внешняя политика Советского государства в 20-30-х гг. Почему в данный период не удалось создать систему международной безопасности | 15.85 KB | |
| Почему в данный период не удалось создать систему международной безопасности Внешняя политика СССР в 2030 гг. СССР добился снятия экономической блокады. 1924-1933 годы постепенного признания СССР.В конце 20х годов произошло резкое ухудшение международного положения СССР. | |||
Пути образования аммиака
Аммиак образуется во всех тканях, особенно в головном мозге, а обезвреживается в печени и почках.
Пути образования:
1)дезаминирование а/к-т;
2)дезаминирование пуриновых оснований;
3)распад пиримидиновых оснований;
4)дезамидирование амидов;
5)дезаминирование биогенных аминов;
6)распад гексозаминов
Дезаминирование – основной путь распада (катаболизма) а/к-т. В сутки подвергается дезаминированию ок.70 г а/к-т.
1)гидролитический
2)восстановительное дезаминирование
3)внутримолекулярное (асп,асн и гис),
4)окислительное (этот вид является основным(глу).
Процесс происходит под действием фермента – глутаматДГ, который находится в активном виде.
Пути обезвреживания аммиака .
Аммиак в малых дозах – это физиологический раздражитель, в больших – токсическое вещество. Поэтому концентрация аммиака в организме должна находиться на низком уровне – 60 мкМ/л. Гомеостаз аммиака поддерживается за счет его обезвреживания в тканях.
Пути :
1)амидирование;
2)аммонийгенез;
3)восстановительное аминирование;
4)синтез мочевины.
Аммиак, образующийся при дезамидировании в печени, обезвреживается, используясь на синтез мочевины. В почках - на образование аммонийных солей(аммонийгенез). В печени и других тканях аммиак обезвреживается в р-те реакции восстановительного аминирования. Преимущественно в печени идет процесс образования мочевины, являющийся основным путем обезвреживания аммиака.
Образование мочевины получило название орнитиновый цикл, или цитруллиновая теория. Синтез мочевины протекает в МТХ печени. Предварительно в МТХ под действием карбамоилфосфатсинтетазы I с затратой 2АТФ аммиак связывается с СО2 с образованием карбамоилфосфата:
1.В МТХ орнитинкарбамоилтрансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется - цитруллин:
2.В цитозоле аргининосукцинатсинтетаза с затратой 1АТФ(2макроэргических связей)связывает цитруллин с аспартатом и образуется аргининосукцинат(аргининоянтарная к-та).Фермент нуждается в Mg2+.мАспартат-источник 2ого атома азота мочевины.
3.В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
Фумарат в ЦТК.
4.В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+,ингибиторы-высокие концентрации орнитина и лизина.
![]()
Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Мочевина в кровь->почки->выводится.
Общее уравнение синтеза мочевины:
CO2+NH3+асп+3АТФ+2Н2О→мочевина+ фумарат+2АДФ+АМФ+2Фн+ФФн.
На синтез 1 молекулы мочевины расходуются 4 макроэргических связи 3АТФ.
Ф-ии цикла:
1.превращает азота АК в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов,главным образом аммиака.
2.синтез аргинина и пополнение его фонда в организме.
Нарушение цикла:
1.Гипераммониемия 1 типа - дефект карбомаилфосфат синтетазы.
2.Гипераммониемия 2типа
3.Цитруллинемия
4.Оргининсукцинатомия
5.Гиперарининемия.
Мочевинообразование - одна из важнейших дезинтоксикационных функций печени , заключающихся в преобразовании ядовитых осколков белковой молекулы в нетоксичное вещество. При дезаминировании а/к-т, нуклеотидов и др.азотистых соединений печень принимает участие в синтезе аммиака, превышение предельно допустимых концентраций которого становится высокотоксичным для организма. Дезинтоксикация аммиака происходит посредством использования его для синтеза мочевины.
Полнотекстовый поиск:
Главная > Реферат >Биология
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ТИХООКЕАНСКИЙ ГОСУДАРСТВЕНЫЙ ЭКОНОМИЧЕСКИЙ
УНИВЕРСИТЕТ
Кафедра инженерных дисциплин и ресурсосберегающих технологий
РЕФЕРАТ
По дисциплине: «Система управления химико-технологическими процессами»
Тема: Протеолиз. Цикл мочевины.
Выполнил:
Студент гр -----ПБ
Проверил:
Преподаватель
Шлихт А. Г.
г. Владивосток
1. Белковый обмен: общие сведения 3
2. Протеолиз 4
3. Цикл мочевины 6
4. Мочевина 8
Список литературы 10
1. Белковый обмен: общие сведения
В количественном отношении белки образуют самую важную группу макромолекул. В организме человека массой 70 кг содержится примерно 10 кг белка, причем большая его часть локализована в мышцах. По сравнению с белками доля других азотсодержащих веществ в организме незначительна. Поэтому баланс азота в организме определяется метаболизмом белков, который регулируется несколькими гормонами, прежде всего тестостероном и кортизолом.
В организме взрослого человека метаболизм азота в целом сбалансирован, т. е. количества поступающего и выделяемого белкового азота примерно равны. Если выделяется только часть вновь поступающего азота, баланс положителен. Это наблюдается, например, при росте организма. Отрицательный баланс встречается редко, главным образом как следствие заболеваний.
Полученные с пищей белки подвергаются полному гидролизу в желудочно-кишечном тракте до аминокислот, которые всасываются и кровотоком распределяются в организме. 8 из 20 белковых аминокислот не могут синтезироваться в организме человека. Эти незаменимые аминокислоты должны поступать с пищей.
Через кишечник и в небольшом объеме также через почки организм постоянно теряет белок. В связи с этими неизбежными потерями ежедневно необходимо получать с пищей не менее 30 г белка. Эта минимальная норма едва ли соблюдается в некоторых странах, в то время как в индустриальных странах содержание белка в пище чаще всего значительно превышает норму. Аминокислоты не запасаются в организме, при избыточном поступлении аминокислот в печени окисляется или используется до 100 г аминокислот в сутки. Содержащийся в них азот превращается в мочевину и в этой форме выделяется с мочой, а углеродный скелет используется в синтезе углеводов, липидов или окисляется с образованием АТФ.
Предполагается, что в организме взрослого человека ежедневно разрушается до аминокислот 300-400 г белка (протеолиз) В тоже время примерно тоже самое количество аминокислот включается во вновь образованные молекулы белков (белковый биосинтез). Высокий оборот белка в организме необходим потому, что многие белки относительно недолговечны: они начинают обновляться спустя несколько часов после синтеза, а биохимический полупериод составляет 2-8 дней. Еще более короткоживущими оказываются ключевые ферменты промежуточного обмена. Они обновляются спустя несколько часов после синтеза. Это постоянное разрушение и ресинтез позволяют клеткам быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов. В противоположность этому особенно долговечны структурные белки, гистоны, гемоглобин или компоненты цитоскелета.
Внутриклеточное разрушение белков (протеолиз) происходит частично в липосомах. Кроме того, в цитоплазме имеются органеллы, так называемые протеасомы, в которых разрушаются неправильно свернутые или денатурированные белки. Такие молекулы узнаются с помощью специальных маркеров.
2. Протеолиз
Процесс расщепления белков до свободных аминокислот называется протеолиз. Для полного расщепления белков до свободных аминокислот необходимо несколько ферментов с различной специфичностью. Протеиназы и пептидазы имеются не только в желудочно-кишечном тракте, но и в клетках. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы. Эндопептидазы, или протеиназы, расщепляют пептидную связь внутри пептидной цепи. Они «узнают» и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определенными аминокислотными остатками. Протеиназы классифицируются по механизму реакции. Сериновые протеиназы содержат в активном центре важный для каталитического действия этих ферментов остаток серина, в цистеиновых протеиназах таким является остаток цистеина и т.д. Экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы - с N-конца, карбоксипептидазы - с С-конца. Наконец, дипептидазы расщепляют только дипептиды.
Протеасомы
Поскольку функциональные белки клетки должны быть защищены от преждевременного протеолиза, часть протеолитических ферментов клетки заключена в липосомы (см. с. 228). Другая хорошо регулируемая система деградации белков локализована в цитоплазме. Она состоит из больших белковых комплексов (молекулярная масса 2ּ106 Да), протеасом. Протеасомы содержат бочковидное ядро из 28 субъединиц и имеют коэффициент седиментации 20S. Протеолитическая активность (на схеме показана в виде ножниц) локализована во внутреннем 20S-ядре. С торцов бочки запираются сложно устроенными 19S-частицами, контролирующими доступ в ядро.
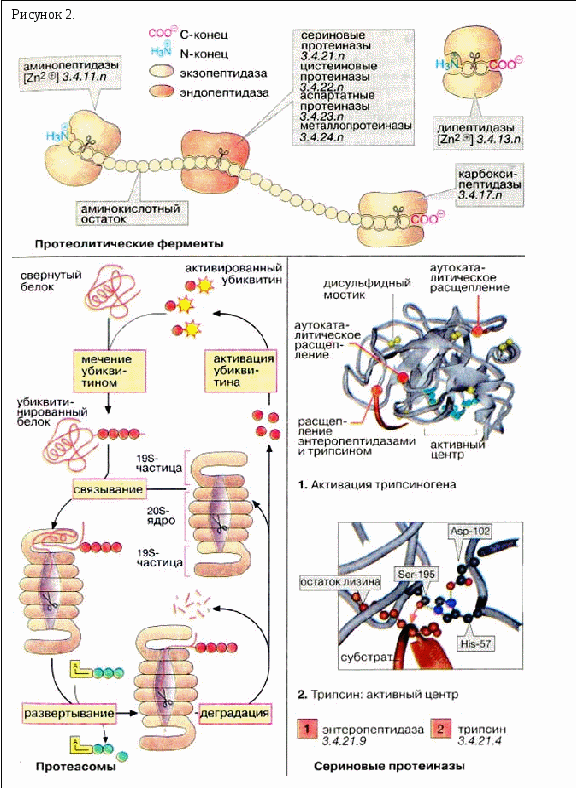
Белки, которым предстоит разрушение в протеасоме (например, содержащие ошибки транскрипции или состарившиеся молекулы), метятся путем ковалентного связывания с небольшим белком убиквитином. Убиквитин активирован благодаря наличию тиолсложноэфирной связи. Меченые убиквитином («убиквитинированные») молекулы распознаются 19S-частицами с потреблением АТФ и попадают в ядро, где происходит их деградация. Убиквитин не разрушается и после активации используется вновь.
Сериновые протеиназы
Большая группа протеиназ содержит в активном центре серин. К сериновым протеиназам принадлежат, например, ферменты пищеварения трипсин, химотрипсин и эластаза, многие факторы свертывания крови, а также фибринолитический фермент плазмин и его активаторы.
Как показано на рисунке, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). хуй начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы А и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента.
3. Цикл мочевины
Цикл мочевины, циклический ферментативный процесс, состоящий из последовательных превращений аминокислоты орнитина и приводящий к синтезу мочевины. Цикл мочевины. - важнейший путь ассимиляции аммиака (и тем самым его обезвреживания) у многих видов животных, а также у растений и микроорганизмов. Лучше всего реакции цикла мочевины. изучены у млекопитающих (Х. Кребс и К. Хензелейт, 1932, и др.), у которых они осуществляются преимущественно в печени. Цикл мочевины состоит из трёх основных реакций: превращение орнитина в цитруллин, цитруллина - в аргинин и расщепление аргинина на мочевину и орнитин.
Цикл мочевины обнаружен у млекопитающих, лягушек, черепах, дождевых червей, но отсутствует у змей, птиц, и у костистых рыб (у акуловых он функционирует). У растений и микроорганизмов цикл мочевины - важный путь связывания аммонийных солей и превращения их в органические азотистые соединения.
Расщепление аминокислот происходит преимущественно в печени. При этом непосредственно или косвенно освобождается аммиак. Значительные количества аммиака образуются при распаде пуринов и пиримидинов.
Аммиак (на схеме наверху слева), основание средней силы, является клеточным ядом. При высоких концентрациях он повреждает главным образом нервные клетки. Поэтому аммиак должен быстро инактивироваться и выводиться из организма. В организме человека это осуществляется прежде всего за счет образования мочевины (на схеме в середине слева), часть NH 3 выводится непосредственно почками.
У разных видов позвоночных инактивация и выведение аммиака производятся различными способами. Живущие в воде животные выделяют аммиак непосредственно а воду; например, у рыб он выводится через жабры (аммониотелические организмы). Наземные позвоночные, в том числе человек, выделяют лишь небольшое количество аммиака, а основная его часть превращается в мочевину (уреотелические организмы). Птицы и рептилии, напротив, образуют мочевую кислоту, которая в связи с экономией воды выделяется преимущественно в твердом виде (урикотелические организмы).
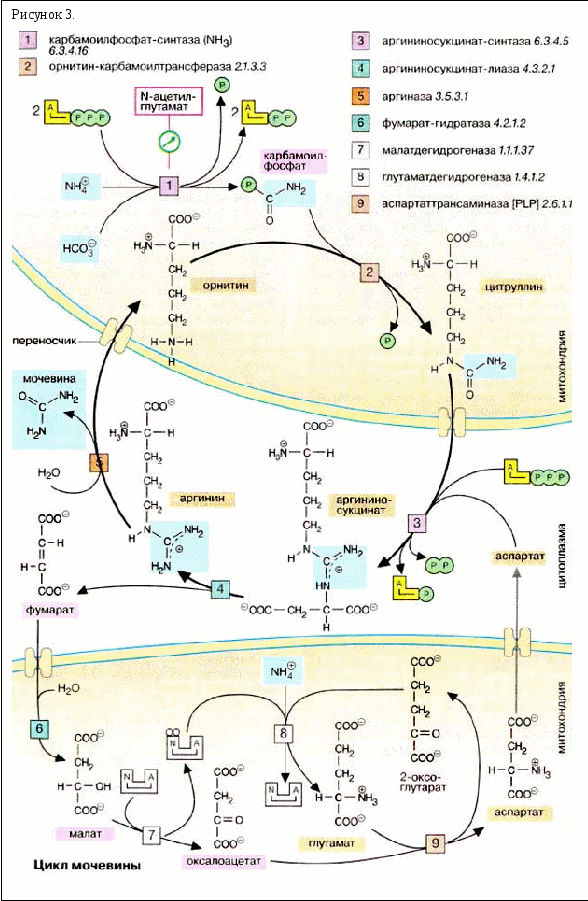
Мочевина образуется в результате циклической последовательности реакций, протекающих в печени. Оба атома азота берутся из свободного аммиака и за счет дезаминирования аспартата, карбонильная группа - из гидрокарбоната. На первой стадии, реакция , из гидрокарбоната (НСО 3 -) и аммиака с потреблением 2 молекул АТФ образуется карбамоилфосфат. Как ангидрид это соединение обладает высоким реакционным потенциалом. На следующей стадии, реакция , карбамоильный остаток переносится на орнитин с образованием цитруллина. Вторая аминогруппа молекулы мочевины поставляется за счет реакции аспартата (на схеме внизу справа) с цитруллином . Для этой реакции вновь необходима энергия в форме АТФ, который при этом расщепляется на АМФ и дифосфат. Для обеспечения необратимости реакции дифосфат гидролизуется полностью (не показано). Отщепление фумарата от аргининосукцината приводит к аргинину , из которого в результате гидролиза образуется изомочевина , сразу же превращающаяся в результате перегруппировки в мочевину. Остающийся орнитин вновь включается в цикл мочевины.
Фумарат, образующийся в цикле мочевины, может в результате двух стадий цитратного цикла через малат переходить в оксалоацетат, который за счет трансаминирования далее прекращается в аспартат. Последний также вновь вовлекается в цикл мочевины.
Биосинтез мочевины требует больших затрат энергии. Необходимая энергия поставляется за счет расщепления четырех высокоэнергетических связей: двух при синтезе карбамоилфосфата и двух (!) при образовании аргининосукцината (АТФ → АМФ + PPi, РРi → 2Pi).
Цикл мочевины протекает исключительно в печени. Он разделен на два компартмента, митохондрии и цитоплазму. Прохождение через мембрану промежуточных соединений цитруллина и орнитина возможно только с помощью переносчиков. Обе аминокислоты небелкового происхождения.
Скорость синтеза мочевины определяется первой реакцией цикла . Карбамоилфосфатсинтаза активна только в присутствии N-ацетилглутамата. Состояние обмена веществ (уровень аргинина, энергоснабжение) сильно зависит от концентрации этого аллостерического эффектора.
4. Мочевина
Мочевина, карбамид, H3NCONH3, полный амид угольной кислоты, амид карбаминовой кислоты; бесцветные кристаллы (t пл 132,7°C), легко растворимые в воде, спирте, жидком аммиаке, сернистом ангидриде. Открыта французским химиком И. Руэллем (1773) в моче, идентифицирована английским химиком У. Праутом (1818), впервые синтезирована Ф. Вёлером (1828) нагреванием циановокислого аммония NH5NCO. Именно это открытие нанесло первый удар идеалистическому виталистическому учению о так называемой жизненной силе. Мочевина - весьма реакционно-способное соединение; образует комплексные соединения с многими веществами, например с перекисью водорода CO (NH 2) 2 ·H 2 O 2 , с нормальными насыщенными углеводородами; последняя реакция используется в промышленности для депарафинизации нефтей (см. также Соединения включения). При нагревании до 150-160°C мочевина разлагается с образованием биурета H 2 NCONHCONH 2 , NH 3 , CO 2 и др. продуктов; при нагревании водных растворов медленно гидролизуется до CO 2 и NH 3 (быстро в присутствии кислот и щелочей), с кислотами (HNO 3 , HCl и др.) даёт соли, например CO (NH 2) 2 ·HNO 3 . При алкилировании. образуются алкилмочевины RNHCONH 2 , при ацилировании - уреиды RCONHCONH 2 , при взаимодействии со спиртами - уретаны H 2 NCOOR. М. легко конденсируется с формальдегидом. Атом водорода в группе NH 2 может быть замещен также на атомы галогена (F, Cl 2).
Мочевина. - конечный продукт белкового обмена у большинства позвоночных животных и человека. Обнаружена в крови, мышцах, слюне, лимфе, молоке и др. жидкостях и тканях (содержание в крови человека в норме 18-38 мг/100 мл). Биосинтез мочевины из конечных продуктов распада белков - NH4 и CO 2 - происходит в печени в результате ряда биохимических реакций - цикла мочевины, или орнитинового цикла (М. и орнитин образуются при ферментативном расщеплении аминокислоты аргинина). У животных, связывающих NH 3 в мочевую кислоту, орнитиновый цикл утрачен.
Мочевина. участвует в регуляции водного режима животных: поддерживает гипертоничность тканей (акуловые рыбы) и обеспечивает их гидратацию (наземные животные). Мочевина. выводится почками и потовыми железами (человек выделяет около 25-30 г. в сутки). Содержание мочевины в моче зависит от количества и состава белков в пище, уровня распада белков (увеличивается при физической работе, повышении температуры тела, сахарном диабете). При нарушении функции почек и заболеваниях, связанных с усиленным распадом тканевых белков, содержание мочевины. в крови возрастает.
В промышленности мочевину. получают из аммиака и двуокиси углерода (160-200 °C, 100-400 ат):
2NH4 + CO2 ® ® H3NCONH3 + H3O.
Она находит широкое применение. мочевина - исходный материал для получения карбамидных смол, а также удобрений, цианатов, гидразина, циануровой кислоты и её эфиров, некоторых красителей, снотворных средств (например, веронала, люминала, бромурала); в медицинской практике мочевину. чистую используют как дегидратационное средство для предупреждения и уменьшения отёка мозга и т. п.
ПротеолизаКонтрольная работа >> Биология
Нервов. Секреторный цикл фолликулов - В секреторном цикле фолликулов различают две... помощью лизосомального аппарата подвергаются протеолизу и из молекул фагоцитированного... (0,6%), хлористый натрий (0,5%), примеси мочевины , холена и летучих жирных кислот...







